Dalam kimia , pH adalah ukuran dari keasaman atau kebasaan dari suatu larutan berair . [1] air murni dikatakan netral, dengan pH 7,0 dekat pada 25 ° C (77 ° F ). Solusi dengan pH kurang dari 7 dikatakan asam dan solusi dengan pH lebih dari 7 yang dasar atau alkali . pengukuran pH adalah penting dalam kedokteran , biologi , kimia , pertanian , kehutanan , ilmu pangan , ilmu lingkungan , oseanografi , teknik sipil dan banyak aplikasi lainnya.
Dalam pH larutan mendekati tetapi tidak sama dengan p [H], negatif logaritma (basis 10) dari konsentrasi molar dari terlarut ion hidronium (H 3 O +); pH rendah menunjukkan konsentrasi tinggi ion hidronium, sementara pH yang tinggi menunjukkan konsentrasi rendah. Ini negatif logaritma sesuai dengan jumlah tempat di belakang titik desimal, jadi, misalnya, 0,1 molar asam klorida harus dekat pH 1 dan 0,0001 molar HCl harus dekat pH 4 (basis 10 logaritma dari 0,1 dan 0,0001 menjadi -1 , dan -4, masing-masing). Murni (de-terionisasi) air netral, dan dapat dianggap baik asam yang sangat lemah atau basa yang sangat lemah (pusat skala pH 0 sampai 14), memberikan pH 7 (pada 25 ° C (77 ° F )), atau 0.0000001 M H +. [2] Untuk larutan berair memiliki pH yang lebih tinggi, dasar harus dilarutkan di dalamnya, yang mengikat diri banyak dari ion hidrogen langka. Ion hidrogen dalam air dapat ditulis hanya dengan H + atau sebagai hidronium (H 3 O +) atau spesies yang lebih tinggi (misalnya, H 9 O 4 +) untuk memperhitungkan solvasi , tetapi semua menggambarkan entitas yang sama. Kebanyakan badan air tawar permukaan bumi sedikit asam karena kelimpahan dan penyerapan karbon dioksida; [3] pada kenyataannya, selama ribuan tahun di masa lalu, badan air yang paling segar telah lama ada pada tingkat pH sedikit asam.
Namun, pH tidak tepat p [H], tapi memperhitungkan suatu faktor aktivitas . Ini merupakan kecenderungan ion hidrogen untuk berinteraksi dengan komponen lain dari solusi, yang mempengaruhi antara lain potensi listrik membaca menggunakan pH meter . Akibatnya, pH dapat dipengaruhi oleh kekuatan ionik dari solusi-misalnya, pH dari 0,05 M kalium hidrogen ftalat solusi dapat bervariasi sebanyak 0,5 unit pH sebagai fungsi ditambahkan kalium klorida , meskipun ditambahkan garam tidak asam atau dasar. [4]
Ion hidrogen koefisien aktivitas tidak dapat diukur secara langsung dengan metode suara termodinamika, sehingga mereka didasarkan pada perhitungan teoritis. Oleh karena itu, skala pH didefinisikan dalam praktek sebagai dilacak untuk satu set larutan standar yang pH dibentuk oleh perjanjian internasional. [5] nilai pH Primer standar ditentukan oleh sel Harned , elektroda gas hidrogen, menggunakan Bates-Guggenheim Konvensi .
pH dalam arti biasa adalah ukuran dari keasaman (encer) larutan berair saja. [1] Baru-baru ini konsep "skala pH Bersatu" [6] telah dikembangkan berdasarkan potensi kimia mutlak proton. Konsep ini mengusulkan "pH Bersatu" sebagai ukuran keasaman yang berlaku untuk media apapun: cairan, gas dan bahkan padatan.
Tidak diketahui apa definisi yang tepat dari 'p' pada pH. Sebuah definisi umum sering digunakan di sekolah adalah "persentase". Namun beberapa referensi menyarankan p singkatan dari "Power", [10] orang lain merujuk pada Jerman kata "Potenz" (artinya kekuasaan di Jerman), [11] yang lain mengacu pada "potensi". Jens Norby mempublikasikan sebuah makalah pada tahun 2000 menyatakan bahwa p adalah sebuah konstan dan singkatan "logaritma negatif"; [12] H kemudian berdiri untuk Hidrogen. Menurut pH Carlsberg Foundation singkatan dari "kekuatan hidrogen". [10] saran lain yang telah muncul selama bertahun-tahun adalah bahwa p singkatan puissance (yang juga berarti kekuasaan, didasarkan pada kenyataan bahwa Laboratorium Carlsberg adalah berbahasa Perancis) , atau pH yang berdiri untuk istilah Latin pondus Hydrogenii atau potentia hydrogenii. Hal ini juga menyarankan bahwa Sørensen menggunakan huruf p dan q (umumnya pasangan huruf dalam matematika) hanya untuk label larutan uji (p) dan solusi referensi (q). [13]
Definisi ini, dengan sendirinya, adalah sepenuhnya tidak praktis, karena aktivitas ion hidrogen adalah produk dari konsentrasi dan koefisien aktivitas . Untuk mendapatkan hasil yang tepat, elektroda harus dikalibrasi menggunakan larutan standar kegiatan diketahui.
Para Definisi operasional pH secara resmi didefinisikan oleh Standar Internasional ISO 31-8 sebagai berikut: [15] Untuk X solusi, pertama mengukur gaya gerak listrik E X dari sel galvanik
Pengukuran nilai pH sangat rendah, seperti beberapa perairan tambang yang sangat asam, [17] memerlukan prosedur khusus. Kalibrasi elektroda dalam kasus tersebut dapat dilakukan dengan larutan standar asam sulfat pekat, yang nilai pH dapat dihitung dengan menggunakan parameter Pitzer untuk menghitung koefisien aktivitas. [18]
pH adalah contoh dari sebuah fungsi keasaman . Konsentrasi ion hidrogen dapat diukur dalam pelarut non-air, tetapi ini mengarah, pada dasarnya, untuk fungsi keasaman yang berbeda, karena keadaan standar untuk non-pelarut berair berbeda dari keadaan standar untuk air. superacids adalah kelas non -berair asam dimana fungsi keasaman Hammett , H 0, telah dikembangkan.
Perbedaan antara p [H] dan pH sangat kecil. Telah dinyatakan [20] pH yang = p [H] + 0,04. Ini adalah praktek umum untuk menggunakan "pH" istilah untuk kedua jenis pengukuran.
Karena elektrode kaca (dan lainnya elektroda selektif ion ) menanggapi aktivitas, elektroda harus dikalibrasi dalam media serupa yang sedang diselidiki. Misalnya, jika seseorang ingin mengukur pH sampel air laut, elektroda harus dikalibrasi dalam larutan menyerupai air laut di komposisi kimianya, sebagai berikut.
Suatu ukuran perkiraan pH dapat diperoleh dengan menggunakan indikator pH . Sebuah indikator pH adalah zat yang berubah warna di sekitar nilai pH tertentu. Ini adalah asam lemah atau basa lemah dan perubahan warna terjadi sekitar 1 unit pH pada tiap sisi nya tetapan disosiasi asam , atau p K, nilai. Misalnya, indikator alami lakmus merah dalam larutan asam (pH <7 pada 25 ° C (77 ° F )) dan biru dalam basa (pH> 7 pada 25 ° C (77 ° F )) solusi. Indikator universal terdiri dari campuran indikator seperti bahwa ada perubahan warna terus menerus dari sekitar pH 2 sampai pH 10. Kertas indikator universal kertas sederhana yang telah diresapi dengan indikator universal.
Sebuah solusi yang pH 7 (pada 25 ° C (77 ° F )) dikatakan netral, artinya, bukan asam atau dasar. Air dikenakan diri ionisasi proses.
Masalah umum yang dihadapi adalah untuk menghitung pH larutan konsentrasi tertentu asam kuat. Biasanya, konsentrasi asam akan sangat tinggi dibandingkan dengan konsentrasi awal ion H + dalam air murni, yang 10 -7 molar . Dalam kondisi ini, H + konsentrasi ion sangat mendekati bahwa dari konsentrasi asam, dan pH dihitung hanya dengan mengambil logaritma negatif dari nilai yang [23]
Misalnya, untuk solusi 0.01M HCl, H + konsentrasi dapat diambil sebagai 0.01M, dan pH-log 10 (0,01). Artinya, pH = 2.
Untuk konsentrasi sangat lemah, konsentrasi yaitu sekitar 10 -6 M atau kurang, konsentrasi awal ion H + dalam air murni menjadi signifikan, dan harus diperhitungkan. [24] Metode solusi adalah sebagai berikut. Pada kesetimbangan, setiap larutan encer harus memenuhi persamaan kesetimbangan disosiasi air,
Perhatikan bahwa untuk reaksi yang diberikan, C adalah konstan. Persamaan ini hanya mengatakan bahwa molekul asam dapat menjadi terprotonasi atau terionisasi, tetapi bahwa jumlah akan tetap sama.
Untuk asam kuat yang benar-benar dipisahkan, [A -]>> [HA], dan [HA] panjang dapat dijatuhkan:
Sebagai contoh, untuk menemukan pH larutan 5 × 10 -8 M HCl, dicatat pertama bahwa konsentrasi ini kecil dibandingkan dengan konsentrasi baseline [H +] dalam air (10 -7). Jadi persamaan kuadrat yang diperoleh di atas harus digunakan.
Dalam hal ini, asam tidak sepenuhnya dipisahkan, namun derajat disosiasi diberikan oleh persamaan kesetimbangan untuk asam yang:
Sebagai contoh, perhatikan masalah menemukan pH larutan 0.01M dari asam benzoat , mengingat bahwa, untuk asam ini, K a = 6,5 × 10 -5 (pK a = 4.19).
Persamaan kesetimbangan untuk reaksi ini adalah
 tergantung pH pigmen tumbuhan yang dapat digunakan sebagai indikator pH terjadi pada banyak tanaman, termasuk bunga sepatu , kubis merah ( antosianin ), [25] dan anggur merah .
tergantung pH pigmen tumbuhan yang dapat digunakan sebagai indikator pH terjadi pada banyak tanaman, termasuk bunga sepatu , kubis merah ( antosianin ), [25] dan anggur merah .
Sebagai bagian dari definisi operasional dari skala pH, IUPAC mendefinisikan serangkaian solusi penyangga di berbagai nilai pH (sering dilambangkan dengan NBS atau NIST penunjukan). Solusi ini memiliki relatif rendah kekuatan ionik (~ 0,1) dibandingkan dengan air laut (~ 0,7), dan, sebagai akibatnya, tidak direkomendasikan untuk digunakan dalam karakterisasi pH air laut, karena perbedaan kekuatan ionik menyebabkan perubahan potensial elektroda . Untuk mengatasi masalah ini, serangkaian alternatif buffer berdasarkan air laut buatan dikembangkan. [28] Seri baru ini akan mengatasi masalah perbedaan kekuatan ionik antara sampel dan buffer, dan skala pH baru disebut sebagai skala total, sering dinotasikan sebagai T pH.
Skala total didefinisikan menggunakan medium yang mengandung sulfat ion. Ini pengalaman ion protonasi , H + + SO 4 2 - ⇌ HSO 4 -, sehingga skala total mencakup efek dari kedua proton (ion hidrogen bebas) dan ion hidrogen sulfat:
Lain skala, yang dikenal sebagai skala air laut, SWS pH sering dilambangkan, memperhitungkan hubungan protonasi lebih lanjut antara ion hidrogen dan fluorida ion, H + + F - HF ⇌. Sehingga dalam ekspresi berikut untuk [H +] SWS:
Berikut tiga persamaan meringkas tiga skala pH:
PH dari kompartemen selular yang berbeda, cairan tubuh , dan organ biasanya diatur secara ketat dalam proses yang disebut homeostasis asam-basa .
PH darah biasanya sedikit dasar dengan nilai pH 7,365. Nilai ini sering disebut sebagai pH fisiologis dalam biologi dan kedokteran.
Plak dapat menciptakan lingkungan asam lokal yang dapat mengakibatkan kerusakan gigi oleh demineralisation.
Enzim dan protein memiliki rentang pH optimum dan dapat menjadi tidak aktif atau didenaturasi luar kisaran ini.
Gangguan yang paling umum dalam asam-basa homeostasis asidosis , yang berarti kelebihan asam dalam tubuh, umumnya didefinisikan oleh pH turun di bawah 7,35. [ kutipan diperlukan ]
Dalam darah, pH dapat diperkirakan dari diketahui kelebihan basa (menjadi) dan bikarbonat konsentrasi (HCO 3 -) dengan persamaan berikut: [33]
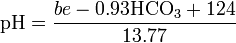
Limpasan dari tambang / tailing tambang dapat menghasilkan beberapa asam pH yang paling yang pernah dilaporkan;. Dengan pH negatif diukur dan dilaporkan dalam literatur serendah pH -3,6 [35]
Dalam pH larutan mendekati tetapi tidak sama dengan p [H], negatif logaritma (basis 10) dari konsentrasi molar dari terlarut ion hidronium (H 3 O +); pH rendah menunjukkan konsentrasi tinggi ion hidronium, sementara pH yang tinggi menunjukkan konsentrasi rendah. Ini negatif logaritma sesuai dengan jumlah tempat di belakang titik desimal, jadi, misalnya, 0,1 molar asam klorida harus dekat pH 1 dan 0,0001 molar HCl harus dekat pH 4 (basis 10 logaritma dari 0,1 dan 0,0001 menjadi -1 , dan -4, masing-masing). Murni (de-terionisasi) air netral, dan dapat dianggap baik asam yang sangat lemah atau basa yang sangat lemah (pusat skala pH 0 sampai 14), memberikan pH 7 (pada 25 ° C (77 ° F )), atau 0.0000001 M H +. [2] Untuk larutan berair memiliki pH yang lebih tinggi, dasar harus dilarutkan di dalamnya, yang mengikat diri banyak dari ion hidrogen langka. Ion hidrogen dalam air dapat ditulis hanya dengan H + atau sebagai hidronium (H 3 O +) atau spesies yang lebih tinggi (misalnya, H 9 O 4 +) untuk memperhitungkan solvasi , tetapi semua menggambarkan entitas yang sama. Kebanyakan badan air tawar permukaan bumi sedikit asam karena kelimpahan dan penyerapan karbon dioksida; [3] pada kenyataannya, selama ribuan tahun di masa lalu, badan air yang paling segar telah lama ada pada tingkat pH sedikit asam.
Namun, pH tidak tepat p [H], tapi memperhitungkan suatu faktor aktivitas . Ini merupakan kecenderungan ion hidrogen untuk berinteraksi dengan komponen lain dari solusi, yang mempengaruhi antara lain potensi listrik membaca menggunakan pH meter . Akibatnya, pH dapat dipengaruhi oleh kekuatan ionik dari solusi-misalnya, pH dari 0,05 M kalium hidrogen ftalat solusi dapat bervariasi sebanyak 0,5 unit pH sebagai fungsi ditambahkan kalium klorida , meskipun ditambahkan garam tidak asam atau dasar. [4]
Ion hidrogen koefisien aktivitas tidak dapat diukur secara langsung dengan metode suara termodinamika, sehingga mereka didasarkan pada perhitungan teoritis. Oleh karena itu, skala pH didefinisikan dalam praktek sebagai dilacak untuk satu set larutan standar yang pH dibentuk oleh perjanjian internasional. [5] nilai pH Primer standar ditentukan oleh sel Harned , elektroda gas hidrogen, menggunakan Bates-Guggenheim Konvensi .
pH dalam arti biasa adalah ukuran dari keasaman (encer) larutan berair saja. [1] Baru-baru ini konsep "skala pH Bersatu" [6] telah dikembangkan berdasarkan potensi kimia mutlak proton. Konsep ini mengusulkan "pH Bersatu" sebagai ukuran keasaman yang berlaku untuk media apapun: cairan, gas dan bahkan padatan.
Sejarah
Konsep dari p [H] pertama kali diperkenalkan oleh Denmark kimiawan Soren Peder Lauritz Sørensen di Laboratorium Carlsberg pada tahun 1909 [7] [8] dan direvisi untuk pH yang modern pada tahun 1924 setelah menjadi jelas bahwa motive dalam sel tergantung pada kegiatan bukan dari konsentrasi ion hidrogen. [4] Dalam makalah pertama, notasi itu H sebagai subscript ke huruf kecil p, seperti:. p H [9]Tidak diketahui apa definisi yang tepat dari 'p' pada pH. Sebuah definisi umum sering digunakan di sekolah adalah "persentase". Namun beberapa referensi menyarankan p singkatan dari "Power", [10] orang lain merujuk pada Jerman kata "Potenz" (artinya kekuasaan di Jerman), [11] yang lain mengacu pada "potensi". Jens Norby mempublikasikan sebuah makalah pada tahun 2000 menyatakan bahwa p adalah sebuah konstan dan singkatan "logaritma negatif"; [12] H kemudian berdiri untuk Hidrogen. Menurut pH Carlsberg Foundation singkatan dari "kekuatan hidrogen". [10] saran lain yang telah muncul selama bertahun-tahun adalah bahwa p singkatan puissance (yang juga berarti kekuasaan, didasarkan pada kenyataan bahwa Laboratorium Carlsberg adalah berbahasa Perancis) , atau pH yang berdiri untuk istilah Latin pondus Hydrogenii atau potentia hydrogenii. Hal ini juga menyarankan bahwa Sørensen menggunakan huruf p dan q (umumnya pasangan huruf dalam matematika) hanya untuk label larutan uji (p) dan solusi referensi (q). [13]
Definisi
Definisi Matematika
pH didefinisikan sebagai desimal negatif logaritma dari ion hidrogen dalam suatu larutan kegiatan. [14]Definisi ini, dengan sendirinya, adalah sepenuhnya tidak praktis, karena aktivitas ion hidrogen adalah produk dari konsentrasi dan koefisien aktivitas . Untuk mendapatkan hasil yang tepat, elektroda harus dikalibrasi menggunakan larutan standar kegiatan diketahui.
Para Definisi operasional pH secara resmi didefinisikan oleh Standar Internasional ISO 31-8 sebagai berikut: [15] Untuk X solusi, pertama mengukur gaya gerak listrik E X dari sel galvanik
- elektroda referensi | larutan pekat KCl | | solusi X | H 2 | Pt
Pengukuran nilai pH sangat rendah, seperti beberapa perairan tambang yang sangat asam, [17] memerlukan prosedur khusus. Kalibrasi elektroda dalam kasus tersebut dapat dilakukan dengan larutan standar asam sulfat pekat, yang nilai pH dapat dihitung dengan menggunakan parameter Pitzer untuk menghitung koefisien aktivitas. [18]
pH adalah contoh dari sebuah fungsi keasaman . Konsentrasi ion hidrogen dapat diukur dalam pelarut non-air, tetapi ini mengarah, pada dasarnya, untuk fungsi keasaman yang berbeda, karena keadaan standar untuk non-pelarut berair berbeda dari keadaan standar untuk air. superacids adalah kelas non -berair asam dimana fungsi keasaman Hammett , H 0, telah dikembangkan.
p [H]
Ini adalah definisi asli Sørensen, [10] yang digantikan mendukung pH pada tahun 1924. Namun, adalah mungkin untuk mengukur konsentrasi ion hidrogen secara langsung, jika elektroda dikalibrasi dalam hal konsentrasi ion hidrogen. Salah satu cara untuk melakukan hal ini, yang telah digunakan secara luas, adalah untuk titrasi larutan konsentrasi dikenal asam kuat dengan larutan konsentrasi dikenal alkali kuat di hadirat konsentrasi yang relatif tinggi elektrolit latar belakang. Karena konsentrasi asam dan alkali diketahui, adalah mudah untuk menghitung konsentrasi ion hidrogen sehingga potensial terukur dapat dikorelasikan dengan konsentrasi. Kalibrasi biasanya dilakukan dengan menggunakan petak Gran . [19] Kalibrasi yieds nilai untuk potensial elektroda standar, E 0, dan faktor kemiringan, f, sehingga persamaan Nernst dalam bentukPerbedaan antara p [H] dan pH sangat kecil. Telah dinyatakan [20] pH yang = p [H] + 0,04. Ini adalah praktek umum untuk menggunakan "pH" istilah untuk kedua jenis pengukuran.
pOH
pOH kadang-kadang digunakan sebagai ukuran konsentrasi ion hidroksida, OH -, atau alkalinitas . pOH tidak diukur secara independen, namun berasal dari pH. Konsentrasi ion hidroksida dalam air terkait dengan konsentrasi ion hidrogen dengan- [OH -] = K W / [H +]
- pOH = p K W - pH.
Aplikasi
Murni (netral) air memiliki pH sekitar 7 pada 25 ° C (77 ° F ); nilai ini bervariasi dengan suhu. Ketika asam dilarutkan dalam air, pH akan kurang dari 7 (jika pada 25 ° C (77 ° F )). Ketika sebuah basa , atau alkali , dilarutkan dalam air, pH akan lebih besar daripada 7 (jika pada 25 ° C (77 ° F )). Suatu larutan asam kuat, seperti asam klorida , pada konsentrasi 1 mol / L memiliki pH 0. Suatu larutan basa kuat, seperti natrium hidroksida , pada konsentrasi 1 mol / L, memiliki pH 14. Dengan demikian, nilai pH yang diukur akan terletak sebagian besar di kisaran 0 sampai 14. Karena pH adalah skala logaritma, perbedaan satu unit pH setara dengan perbedaan sepuluh kali lipat dalam konsentrasi ion hidrogen.Karena elektrode kaca (dan lainnya elektroda selektif ion ) menanggapi aktivitas, elektroda harus dikalibrasi dalam media serupa yang sedang diselidiki. Misalnya, jika seseorang ingin mengukur pH sampel air laut, elektroda harus dikalibrasi dalam larutan menyerupai air laut di komposisi kimianya, sebagai berikut.
Suatu ukuran perkiraan pH dapat diperoleh dengan menggunakan indikator pH . Sebuah indikator pH adalah zat yang berubah warna di sekitar nilai pH tertentu. Ini adalah asam lemah atau basa lemah dan perubahan warna terjadi sekitar 1 unit pH pada tiap sisi nya tetapan disosiasi asam , atau p K, nilai. Misalnya, indikator alami lakmus merah dalam larutan asam (pH <7 pada 25 ° C (77 ° F )) dan biru dalam basa (pH> 7 pada 25 ° C (77 ° F )) solusi. Indikator universal terdiri dari campuran indikator seperti bahwa ada perubahan warna terus menerus dari sekitar pH 2 sampai pH 10. Kertas indikator universal kertas sederhana yang telah diresapi dengan indikator universal.
| Indikator | PH rendah warna | Transisi kisaran pH | PH tinggi warna |
|---|---|---|---|
| Timol biru (transisi pertama) | Merah | 1,2-2,8 | Kuning |
| Metil merah | Merah | 4,4-6,2 | Kuning |
| Bromothymol biru | Kuning | 6,0-7,6 | Biru |
| Timol biru (transisi kedua) | Kuning | 8,0-9,6 | Biru |
| Fenolftalein | Tanpa warna | 8,3-10,0 | Fuchsia |
- H 2 O
 H + + OH -
H + + OH -
- CO 2 + H 2 O
 H 2 CO 3
H 2 CO 3  HCO 3 - + H +
HCO 3 - + H +
Contoh
Zat  | pH  |
|---|---|
| Timbal-asam baterai [21] | <1 |
| Cuka [22] | 2.0 |
| Baking soda [22] | 9.0 |
Perhitungan pH
Asam kuat dan basa
Asam kuat dan basa adalah mereka yang, untuk tujuan praktis, benar-benar memisahkan (ionisasi) dalam air. Asam klorida (HCl) adalah contoh yang baik dari asam kuat.Masalah umum yang dihadapi adalah untuk menghitung pH larutan konsentrasi tertentu asam kuat. Biasanya, konsentrasi asam akan sangat tinggi dibandingkan dengan konsentrasi awal ion H + dalam air murni, yang 10 -7 molar . Dalam kondisi ini, H + konsentrasi ion sangat mendekati bahwa dari konsentrasi asam, dan pH dihitung hanya dengan mengambil logaritma negatif dari nilai yang [23]
Misalnya, untuk solusi 0.01M HCl, H + konsentrasi dapat diambil sebagai 0.01M, dan pH-log 10 (0,01). Artinya, pH = 2.
Untuk konsentrasi sangat lemah, konsentrasi yaitu sekitar 10 -6 M atau kurang, konsentrasi awal ion H + dalam air murni menjadi signifikan, dan harus diperhitungkan. [24] Metode solusi adalah sebagai berikut. Pada kesetimbangan, setiap larutan encer harus memenuhi persamaan kesetimbangan disosiasi air,
- [H +] [O H -] = K w = 10 - 14
- C = [H A] + [A -]
Perhatikan bahwa untuk reaksi yang diberikan, C adalah konstan. Persamaan ini hanya mengatakan bahwa molekul asam dapat menjadi terprotonasi atau terionisasi, tetapi bahwa jumlah akan tetap sama.
Untuk asam kuat yang benar-benar dipisahkan, [A -]>> [HA], dan [HA] panjang dapat dijatuhkan:
- C = [A -]
- [H +] = [A -] + [O H -]
- [H +] 2 - C [H +] - K w = 0
Sebagai contoh, untuk menemukan pH larutan 5 × 10 -8 M HCl, dicatat pertama bahwa konsentrasi ini kecil dibandingkan dengan konsentrasi baseline [H +] dalam air (10 -7). Jadi persamaan kuadrat yang diperoleh di atas harus digunakan.
- p H = 6,89
Asam dan basa lemah
Masalah dalam kasus ini akan menentukan pH larutan konsentrasi tertentu asam, ketika bahwa asam itu pK atau K (tetapan disosiasi asam) yang diberikan.Dalam hal ini, asam tidak sepenuhnya dipisahkan, namun derajat disosiasi diberikan oleh persamaan kesetimbangan untuk asam yang:
- C = [H A] + [A -]
- [H +] = [A -]
- [H A] = C - [A -] = C - [H +]
- [H +] 2 + K [H +] - K C = 0
Sebagai contoh, perhatikan masalah menemukan pH larutan 0.01M dari asam benzoat , mengingat bahwa, untuk asam ini, K a = 6,5 × 10 -5 (pK a = 4.19).
Persamaan kesetimbangan untuk reaksi ini adalah
- 0,01 M = [H A] + [A -] = [H A] + [H +]
- [H A] = 0,01 M - [H +]
- p H = - log [H +] = 3.11
pH di alam

Hydrangea macrophylla bunga bervariasi dari merah muda ke biru , menurut mobilisasi tergantung pH dan serapan dari aluminium tanah ke tanaman.
Air Laut
PH air laut memainkan peran penting dalam laut siklus karbon , dan ada bukti yang berlangsung pengasaman laut disebabkan oleh emisi karbon dioksida . [26] Namun, pengukuran pH rumit oleh sifat kimia dari air laut , dan beberapa skala pH yang berbeda ada dalam kimia oseanografi . [27]Sebagai bagian dari definisi operasional dari skala pH, IUPAC mendefinisikan serangkaian solusi penyangga di berbagai nilai pH (sering dilambangkan dengan NBS atau NIST penunjukan). Solusi ini memiliki relatif rendah kekuatan ionik (~ 0,1) dibandingkan dengan air laut (~ 0,7), dan, sebagai akibatnya, tidak direkomendasikan untuk digunakan dalam karakterisasi pH air laut, karena perbedaan kekuatan ionik menyebabkan perubahan potensial elektroda . Untuk mengatasi masalah ini, serangkaian alternatif buffer berdasarkan air laut buatan dikembangkan. [28] Seri baru ini akan mengatasi masalah perbedaan kekuatan ionik antara sampel dan buffer, dan skala pH baru disebut sebagai skala total, sering dinotasikan sebagai T pH.
Skala total didefinisikan menggunakan medium yang mengandung sulfat ion. Ini pengalaman ion protonasi , H + + SO 4 2 - ⇌ HSO 4 -, sehingga skala total mencakup efek dari kedua proton (ion hidrogen bebas) dan ion hidrogen sulfat:
- [H +] T = [H +] F + [HSO 4 -]
- [H +] F = [H +] T - [HSO 4 -] = [H +] T (1 + [SO 4 2 -] / K S *) -1
Lain skala, yang dikenal sebagai skala air laut, SWS pH sering dilambangkan, memperhitungkan hubungan protonasi lebih lanjut antara ion hidrogen dan fluorida ion, H + + F - HF ⇌. Sehingga dalam ekspresi berikut untuk [H +] SWS:
- [H +] SWS = [H +] F + [HSO 4 -] + [HF]
Berikut tiga persamaan meringkas tiga skala pH:
- F pH = - log [H +] F
- T pH = - log ([H +] F + [HSO 4 -]) = - log [H +] T
- pH SWS = - log ([H +] F + [HSO 4 -] + [HF]) = - log [H +] SWS
Sistem hidup
| Kompartemen | pH |
|---|---|
| Asam lambung | 1 |
| Lisosom | 4.5 |
| Butiran sel chromaffin | 5.5 |
| Manusia kulit | 5.5 |
| Air seni | 6.0 |
| Netral H 2 O pada suhu 37 ° C | 6.81 |
| Sitosol | 7.2 |
| Cairan serebrospinal (CSF) | 7.3 |
| Darah | 7.34-7.45 |
| Matriks mitokondria | 7.5 |
| Pankreas sekresi | 8.1 |
PH darah biasanya sedikit dasar dengan nilai pH 7,365. Nilai ini sering disebut sebagai pH fisiologis dalam biologi dan kedokteran.
Plak dapat menciptakan lingkungan asam lokal yang dapat mengakibatkan kerusakan gigi oleh demineralisation.
Enzim dan protein memiliki rentang pH optimum dan dapat menjadi tidak aktif atau didenaturasi luar kisaran ini.
Gangguan yang paling umum dalam asam-basa homeostasis asidosis , yang berarti kelebihan asam dalam tubuh, umumnya didefinisikan oleh pH turun di bawah 7,35. [ kutipan diperlukan ]
Dalam darah, pH dapat diperkirakan dari diketahui kelebihan basa (menjadi) dan bikarbonat konsentrasi (HCO 3 -) dengan persamaan berikut: [33]
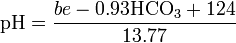
Ekstrem pH
pH biasanya diukur dalam berbagai 0-14. Namun, karena cara pH dihitung, itu mungkin untuk memiliki pH negatif dan pH di atas 14. [34] Namun, perlu dicatat bahwa nilai yang dilaporkan di luar rentang 0-14 yang agak kontroversial, seperti mengukur pH melampaui kisaran ini menjadi sulit.Limpasan dari tambang / tailing tambang dapat menghasilkan beberapa asam pH yang paling yang pernah dilaporkan;. Dengan pH negatif diukur dan dilaporkan dalam literatur serendah pH -3,6 [35]


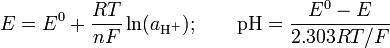

![E = E ^ 0 + f \ frac {RT} {nF} \ ln [\ mbox {H} ^ +]](http://upload.wikimedia.org/math/6/5/4/6547a53032ebdffc5797c8701894cd06.png)

![[H ^ +] = C_a + \ frac {K_w} {[H ^ +]}](http://upload.wikimedia.org/math/6/0/e/60e44409aebe2acc518341cd7cdbb923.png)
![[H ^ +] ^ 2 - 5 \ kali 10 ^ {-8} [H ^ +] - 10 ^ {-14} = 0](http://upload.wikimedia.org/math/4/c/2/4c2d5b9df79a1c6b72a68d8af3853f3b.png)
![[H ^ +] = 1,28 \ kali 10 ^ {-7}](http://upload.wikimedia.org/math/9/1/e/91e9c640b43ee428a1e056cdee7b4411.png)
![K_a = \ frac {[H ^ +] [A HA ^-]}{[]}](http://upload.wikimedia.org/math/1/7/9/1797ef4d5bb0d98ca3803b0932e09832.png)
![K_a = \ frac {[H ^ +] ^ 2} {C_a - [H ^ +]}](http://upload.wikimedia.org/math/2/b/d/2bde22b9d62477afbdd8884e1c1e0c40.png)
![6,5 \ kali 10 ^ {-5} = \ frac {[H ^ +] [A HA ^-]}{[]}](http://upload.wikimedia.org/math/f/d/6/fd6dc2a90fe106d36cb132de10aeae50.png)
![6,5 \ kali 10 ^ {-5} = \ frac {[H ^ +] ^ 2} {[HA]}](http://upload.wikimedia.org/math/c/2/7/c27a5831da9281c3b6e9fe1e4e6f9bbe.png)
![6,5 \ kali 10 ^ {-5} = \ frac {[H ^ +] ^ 2} {0,01 - [H ^ +]}](http://upload.wikimedia.org/math/d/2/7/d275240bc13f75f96857633d2d8526b7.png)
![[H ^ +] ^ 2 + 6,5 \ 10 ^ {kali} -5 [H ^ +] - 6,5 \ kali 10 ^ {-5} \ kali 0,01 = 0](http://upload.wikimedia.org/math/e/4/d/e4dcbd72f271359936d604b91600cec7.png)
![[H ^ +] = 7,74 \ kali 10 ^ {-4}](http://upload.wikimedia.org/math/d/9/1/d9162f8b93e1cfa131c07597e1033169.png)


Tidak ada komentar:
Posting Komentar